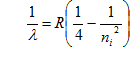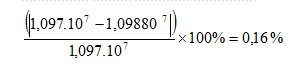Tanggal 28
Oktober 1928 merupakan hari yang bersejarah bagi bangsa kita yaitu hari Sumpah
Pemuda sekaligus merupakan tonggak lahirnya bahasa Indonesia sebagai bahasa
persatuan negara. Penggunaan bahasa Indonesia sebagai bahasa nasional diusulkan
oleh salah satu tokoh pendiri bangsa yaitu Mohammad Yamin. Dalam pidatonya pada
kongres nasional kedua yang diselenggarakan di Jakarta, beliau mengatakan bahwa jika mengacu pada masa depan
bahasa-bahasa yang ada di Indonesia dan kesusastraannya, hanya ada dua bahasa
yang bias diharapkan menjadi bahasa persatuan yaitu bahasa Jawa dan Melayu.
Tapi dari dua bahasa itu, bahasa melayulah yang lambat laun akan menjadi bahasa
pergaulan atau bahasa persatuan.
Sebenarnya jika kita meninjau lebih jauh sebelum bahasa Indonesia diresmikan
sebagai bahasa nasional, bahasa Indonesia berkembang dari sebuah transformasi budaya yang berasal dari
Melayu. Bahasa Indonesia berasal dari bahasa Melayu, sebuah bahasa Austronesia
yang diprediksi telah digunakan sejak abad-abad awal penanggalan modern sebagai
bahasa lingua franca( bahasa pergaulan).
Tanggal 28
Oktober 1928 merupakan hari yang bersejarah bagi bangsa kita yaitu hari Sumpah
Pemuda sekaligus merupakan tonggak lahirnya bahasa Indonesia sebagai bahasa
persatuan negara. Penggunaan bahasa Indonesia sebagai bahasa nasional diusulkan
oleh salah satu tokoh pendiri bangsa yaitu Mohammad Yamin. Dalam pidatonya pada
kongres nasional kedua yang diselenggarakan di Jakarta, beliau mengatakan bahwa jika mengacu pada masa depan
bahasa-bahasa yang ada di Indonesia dan kesusastraannya, hanya ada dua bahasa
yang bias diharapkan menjadi bahasa persatuan yaitu bahasa Jawa dan Melayu.
Tapi dari dua bahasa itu, bahasa melayulah yang lambat laun akan menjadi bahasa
pergaulan atau bahasa persatuan.
Sebenarnya jika kita meninjau lebih jauh sebelum bahasa Indonesia diresmikan
sebagai bahasa nasional, bahasa Indonesia berkembang dari sebuah transformasi budaya yang berasal dari
Melayu. Bahasa Indonesia berasal dari bahasa Melayu, sebuah bahasa Austronesia
yang diprediksi telah digunakan sejak abad-abad awal penanggalan modern sebagai
bahasa lingua franca( bahasa pergaulan).
Bagaimanakah eksistensi bahasa Indonesia di
mata dunia?di era globalisasi ?
Sebagai bangsa
Indonesia, sebenarnya kita harus cukup bangga dengan prestasi yang telah
ditorehkan oleh bahasa nasional kita. Bahasa Indonesia telah mulai dilirik oleh
dunia Internasional baik di lingkup regional yaitu Asean maupun lingkup benua
seperti Australia. Berdasarkan fakta-fakta yang ada, peluang bahasa Indonesia
untuk eksis di dunia global mulai menunjukkan titik terang. Menurut Direktur
Jendral Informasi dan Diplomasi public, Departemen Luar Negeri Andri
Hadi ketika tampil pada pleno kongres IX bahasa Indonesia yang membahas Bahasa Indonesia sebagai Media Diplomasi dalam Membangun Citra
Indonesia di Dunia Internasional di Jakarta menyatakan bahwa: “saat ini ada
45 negara yang mengajarkan bahasa Indonesia seperti Australia, Amerika, Kanada,
Vietnam dan banyak negara lainnya”. Mengambil contoh di Australia, Andri Hadi
menjelaskan;” Di Australia bahasa Indonesia menjadi bahasa polpuler ke empat.
Ada sekitar 500 sekolah mengajarkan bahasa Indonesia, bahkan
anak-anak kelas enam Sekolah Dasar ada yang bisa berbahasa Indonesia”.
Dilingkup wilayah Asean, bahasa Indonesia dijadikan bahasa resmi kedua di
Vietnam. Menurut diplomat Indonesia, pemerintah daerah Ho Chi Minh City Vietnam
mengumumkan bahwa bahwa Indonesia menjadi bahasa kedua secara resmi pada bulan
Desember 2007.”Bahasa Indonesia sejajar dengan bahasa Inggris, Perancis, dan
bahasa Jepang sebagai bahasa kedua yang diprioritaskan”, kata Konsul Jendral RI
di Ho Chi minh City untuk periode 2007-2008 Irdamis Ahmad di Jakarta.Pada akhir
tahun 2010, ketua DPR RI secara terbuka mengusulkan agar bahasa Indonesia
menjadi bahasa resmi di Asean.
Bahasa Indonesia
telah menorehkan prestasi di dunia global?Hal ini wajar saja karena bahasa
Indonesia telah berusia cukup tua yaitu menginjak 84 tahun. Meskipun demikian,
agar bahasa Indonesia tetap eksis di dunia global, maka perlu memperkuat
terlebih dahulu eksistensi bahasa Indonesia di dalam negeri, jangan sampai
seperti tulang yang mengalami Osteoporosis di luar tampak
kokoh dan kuat, nyatanya di dalam rapuh. Seperti dalam pribahasa orang Sunda “
Cul Dog -Dog Tinggal Igel”, yaitu sibuk mengurusi pekerjaan atau permasalahan
yang sekunder sementara permasalahan pokok/ intinya ditinggalkan. Tentunya kita
tidak mau kondisinya seperti itu bukan?
Selain hal-hal positif, era globalisasi juga
memberi dampak negative di dalam negeri. Nyatanya, perkembangan bahasa
Indonesia saat ini telah mengalami degradasi. Kepopuleran bahasa Indonesia di
kalangan masyarakat kalah oleh bahasa-bahasa asing seperti bahasa Inggris,
bahasa Jepang, dll. Orang-orang merasa lumrah saja jika mempelajari bahasa
Indonesia, bahkan merasa inferior (rendah diri) sehingga
merasa lebih modern, intelek,terhormat atau menurut bahasa sekarang “GAUL” jika menggunakan sejumlah
istilah-istilah asing padahal dalam bahasa Indonesia telah ada padanannya.
Untuk itulah, kita perlu memperkuat perkembangan bahasa Indonesia di negeri sendiri. Kita cintai
budaya sendiri karena jika bukan kita maka siapa lagi??????????????????????


.jpg)