A. Tujuan
Menentukan
harga konstanta Rydberg dan spectrum atom Hidrogen
B. Alat dan Bahan
1. Balmer
Lamp (1500 V, 50 mA) 1
Buah
2. Power
Supply ({110-220} V , Vs = 1500 V) 1
Buah
3. Copy
of Rownland Grating 1 Buah
4. Spektrometer 1
Buah
C. Dasar Teori
Spektrum Atomik
Ketika gas atomik atau uap atomic
yang bertekanan rendah diberikan beda potensial, maka atom gas tersebut akan
tereksitasi dan akan memancarkan spectrum yang berisi panjang-panjang gelombang
tertentu saja. Spektrum garis yang dipancarkan setiap unsur berbeda-beda,
sehingga masing-masing unsur memiliki spectrum garis karakteristik.
Pada akhir abad kesembilanbelas
ditemukan bahwa panjang gelombang yang terdapat pada spectrum atomic jatuh pada
kumpulan tertentu yang disebut deret spectral. Deret spectral pertama
didapatkan oleh J.J. Balmer pada tahun 1885 ketika ia mempelajari bagian tampak
dari spectrum Hidrogen.
Balmer melakukan eksperimen untuk mengukur spectrum
yang dipancarkan gas Hidroen dengan menempatkan gas Hidrogen dalam tabung yang
sudah dilengkapi dengan elektroda,(disebut lampu Balmer). Elektroda lampu
balmer disambungkan ke sumber tegangan
DC, dan mengakibatkan lampu balmer menyala dengan warna cahaya berwarna pink.
Spektrum dari lampu balmer itu kemudian diamati dengan menggunakan spectrometer
dan tampak berupa spectrum garis. Fakta eksperimen tersebut bertentangan dengan
model atom Rutherford, yaitu bahwa spectrum atom kontinyu. Hal inilah yang
menjadi kelemahan dari model atom Rutherford. Baik Rutherford maupun Balmer
tidak bias menjelaskan secara teoritis mengapa spectrum atom itu berupa
spectrum garis atau spekrum diskrit.
Niels Bohr berusaha menjelaskan secara teoretis
fakta eksperimen yang diperoleh oleh balmer dan kawan-kawan. Penjelasanya
dinyatakan dalam bentuk postulat. Pada tahun 1913 Neils Bohr mengajukan
postulat tentang atom hidrogen sebagai berikut :
1. Atom
hidrogen terdiri dari sebuah elektron yang bergerak dalam suatu lintas edar
berbentuk lingkaran mengelilingi inti atom; gerak elektron tersebut dipengaruhi
oleh gaya tarik coulomb sesuai dengan kaidah mekanika klasik.
2. Lintas
edar elektron dalam atom hidrogen yang mantap hanyalah yang mempunyai harga
momentum anguler L yang merupakan kelipatan dari tetapan Planck dibagi 2p.
3. Dalam
lintas edar yang mantap elektron yang mengelilingi inti atom tidak memancarkan
energi elektromagnetik. Dalam hal tersebut energi totalnya tidak berubah.
4. Energi
elektromagnetik dipancarkan oleh sistem atom apabila suatu elektron yang
melintasi orbit mantap lain yang berenergi Ef. Pancaran energi elektromagnetnya
memiliki frekuensi n yang besarnya sama dengan :
Kita
dapat menghitung radius orbit dan energi total sistem sebagai berikut :
Gaya
tarik menarik antara elektron dan inti (gaya coulomb) besarnya sama dengan gaya
sentripetal :
Berdasarkan
postulat dua Neils Bohr :
……………………..…….…………(2)
dengan
n adalah bilangan kuantum utama : 1, 2, 3, …
Maka
dari kedua persamaan tersebut dapat diperoleh radius orbit elektron sebagai
berikut :
………………………………… (3)
dan
kecepatan elektron mengelilingi inti :
……………………………………. (4)
Dengan
mengetahui r dan V maka energi total sistem diperoleh sebagai berikut :
Persamaan
(5) tersebut secara langsung menunjukkan besar energi sistem keadaan stasioner
yang diperbolehkan. Tingkat-tingkat energi atom hidrogen ditunjukkan oleh gambar
dibawah ini :
Gambar diatas menunjukkan transisi antara
tingkatan-tingkatan energi atom hidrogen. Garis-garis yang diamati pada
spektrum berhubungan dengan transisi antara tingkat-tingkat energi tersebut.
Seperti terlihat pada gambar, dengan panah-panah menjukkan semua kemungkinan transisi.
Energi
suatu garis-garis diberikan oleh :
dimana
subskrip i dan f masing-masing
menyatakan keadaan awal dan akhir. Berdasarkan postulat Neils Bohr ke empat
yang menyatakan bahwa :
dan
hubungan antara panjang gelombang dan frekuensi dinyatakan dengan :
maka
dari persamaan (6), (7) dan (8) diperoleh :
dengan
R menyatakan konstanta Rydberg = 1,097.107 m-1.
Bila
nf = 1 dan ni ³ 2 maka seluruh
garis-garis jatuh di depan cahaya tampak membentuk deret yang dinamakan deret
Lyman. Bila nf = 2 dan ni ³ 3 maka seluruh
garis-garis jatuh di daerah cahaya tampak membentuk deret yang dinamakan deret
Balmer seperti gambar (1). Garis dengan panjang gelombang terbesar terletak di
daerah merah, disebut Ha yang bersesuaian dengan ni =
3. Selanjutnya Hb bersesuaian dengan ni = 4
dan Hg
bersesuaian dengan ni = 5 masing-masing terletak di daerah biru dan
hijau, demikian seterusnya dan yang terkecil adalah H yang terletak di daerah
ultra ungu.
Menentukan Konstanta Rydberg
Pengukuran panjang gelombang yang dipancarkan oleh
atom hidrogen tereksitasi didasarkan pada prinsip interferensi dengan
menggunakan kisi-kisi. Interferensi konstruktif terjadi bila beda lintasan
merupakan kelipatan dari panjang gelombangnya.
dengan
n adalah orde difraksi = 1, 2, 3, …
Lebar
kisi dapat dihitung berdasarkan kisi difraksi (copy of Rawland Grating) yang
digunakan. Dari Persamaan (9) untuk deret balmer nf = 2
berdasarkan
least square :
dimana
i = 3, 4, 5, ……….
D. Prosedur Eksperimen
1. Mempersiapkan
alat alat yang akan digunkan
2. Memposisikan
agar lampu Balmer dan spektrometer berada pada suatu
garis lurus
3. Memasang kisi difraksi pada spectrometer dan
memastikan agar posisi kisi lurus dan tegaklurus terhadap teropong .
4. Mengkalibrasi
spektrometer dengan mengatur posisi nol derajat pada meja sudut dengan sudut
variabel pada teropong.
5. Menghidupkan
power lampu balmer sehingga cahayanya terdistribusikan ke kisi.
6. Dengan
menggunakan teropong, mengamati spektrum warna yang terbentuk ,baik untuk
posisi pergeseran ke kiri maupun ke kanan.
7. Menentukan
titik tengah dari spectrum warna , yaitu berupa terang pusat yang berwarna
pink.
8. Menggeserkan
teleskop kearah kanan sampai terlihat garis-garis
spektrum warna (orde 1).
Menentukan salah satu warna cahaya ditengah-tengah medan pandang teleskop dan
mencatat besar sudutnya. Mengulangi langkah ini untuk setiap spektrum warna yang terbentuk
pada orde 1.
9. Menggeserkan lagi teleskop kearah kanan sehingga menemukan garis
spketrum warna berikutnya (orde
2) kemudian catat sudutnya pada
data percobaan.Mengulangi langkah ini untuk setiap spektrum warna yang terbentuk
pada orde 2.
10. Mengulangi
langkah 8 dan 9 dengan menggeser teleskop kearah kiri. Sehingga didapatkan dua nilai sudut 𝛉kanan
dan
𝛉kiri.
11.
E. Data Eksperimen
Warna
|
Orde
|
𝛉kanan
|
𝛉kanan
|
Ungu
|
1
|
2,50
|
2,50
|
2
|
5,00
|
5,00
|
|
Hijau
|
1
|
2,72
|
2,77
|
2
|
5,62
|
5,56
|
|
Merah
|
1
|
3,72
|
3,75
|
2
|
7,58
|
7,50
|
F. Pengolahan Data
Menentukan Spektrum pada Atom
Hidrogen
Warna
|
Ordo
|
𝛉kanan
|
𝛉kiri
|
𝛉rata-rata
|
Ungu
|
1
|
2,50
|
2,50
|
2,50
|
2
|
5,00
|
5,00
|
5,00
|
|
Hijau
|
1
|
2,72
|
2,77
|
2,745
|
2
|
5,62
|
5,56
|
5,59
|
|
Merah
|
1
|
3,72
|
3,75
|
3,735
|
2
|
7,58
|
7,50
|
7,54
|
Kisi yang digunakan
memiliki jumlah garis (1000/10) mm , sehingga d = 0,01 mm = 10-5 m.
Warna
|
Ordo
|
𝛉rata-rata
|
𝛌 (m)
|
𝛌 (Å)
|
𝛌rata-rata (Å)
|
Ungu
|
1
|
2,50
|
4.36369E-07
|
4363.693
|
4361.614993
|
2
|
5,00
|
4.35954E-07
|
4359.537
|
||
Hijau
|
1
|
2,745
|
4.79102E-07
|
4791.022
|
4831.718208
|
2
|
5,59
|
4.87241E-07
|
4872.414
|
||
Merah
|
1
|
3,735
|
6.51681E-07
|
6516.807
|
6540.17426
|
2
|
7,54
|
6.56354E-07
|
6563.541
|
Menentukkan
Konstanta Rydberg
Warna
|
ni
|
𝛌rata-rata (Å)
|
R (m-1)
|
Ungu
|
5
|
4.36161E-07
|
10917755.85
|
Hijau
|
4
|
4.83172E-07
|
11038171.32
|
Merah
|
3
|
6.54017E-07
|
11008880.98
|
Jumlah
|
32964808.15
|
||
Rata-rata
|
10988269.38
|
||
Jadi
nilai R yang diperoleh dari percobaan ini adalah
Kesalahan
relatif terhadap konstanta Rydberg standar sebesar














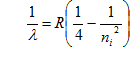








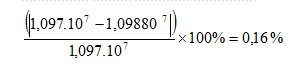





0 comments:
Post a Comment